Метод молекулярных орбиталей был разработан в 1927-1932 годах XX века. Заметную роль в развитии этого метода сыграли работы Р.Малликена и Ф.Хунда. Название предложил в 1928 году Д.Леннард-Джонс. Необходимость создания метода молекулярных орбиталей (МО) возникла в связи с тем, что в теории ковалентной связи оставались вопросы, которые не могли быть объяснены методом валентных связей (ВС).
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар. Однако в ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2+ одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может; она противоречит его основному положению. В простом приближении метода ВС возникают большие трудности при описании электронного строения и свойств сопряженных и ароматических соединений. Метод ВС не объясняет также роли неспаренных электронов в молекуле; ряда свойств комплексных соединений.
Метод молекулярных орбиталей обладает рядом преимуществ, особенно в том случае, когда необходимы пространственные теоретические расчеты; исследование спектров и, следовательно, фотохимических свойств молекул.
Предъявление к методу ВС современных требований по расчету молекулярных характеристик и истолкованию спектров молекул приводит к возникновению значительных трудностей. В связи с этим при описании электронного строения молекул целесообразнее пользоваться методом МО.
Основные положения метода МО
- Молекула рассматривается как целое, а не как совокупность сохраняющих некоторую индивидуальность атомов. Каждый электрон принадлежит молекуле в целом и находится в поле всех её ядер и электронов.
- Состояние электрона описывается волновой функцией. Функция эта называется молекулярной орбиталью. Таким образом, каждому электрону в молекуле соответствует молекулярная орбиталь (МО), подобно тому, как каждому электрону в атоме соответствует атомная орбиталь (АО). В отличие от одноцентровой АО молекулярная орбиталь в общем случае многоцентровая, так как число ядер в молекуле не менее двух.
- Каждой МО соответствует определенная энергия, приближенно характеризуемая потенциалом ионизации с данной орбитали. При переходе хотя бы одного электрона молекулы с занятой на более высокую свободную МО молекула в целом переходит из основного состояния в возбужденное состояние. Для молекулы существует строго определенный набор состояний, которым отвечают определенные значения энергии. Переходы между этими состояниями, сопровождаемые поглощением или излучением квантов энергии, рождают электронный спектр молекулы.
- Совокупность МО молекулы, занятых электронами, называется электронной конфигурацией молекулы. Электронная конфигурация молекулы, так же, как и атома, строится на основе фундаментальных положений - принципа наименьшей энергии (электрон занимает в молекуле свободную орбиталь с наименьшей энергией); принципа Паули (на одной МО не может находиться более двух электронов, при этом спины электронов должны быть антипараллельны); правила Хунда.
- В первом приближении МО представляет собой линейную комбинацию (т.е. результат сложения или вычитания) атомных орбиталей. Поэтому говорят о методе МО ЛКАО (сокращенное название образовано из начальных букв слов: молекулярная орбиталь линейной комбинации атомных орбиталей). При линейной комбинации из N АО образуется N МО.
Построение молекулярной орбитали методом МО ЛКАО
При построении МО по методу ЛКАО должны соблюдаться следующие условия:
- Комбинируемые АО должны быть близкими по энергии: если АО атома Х намного ниже по энергии АО атома У, то, попав в область Х, электрон не перейдет в область У, так как это будет энергетически невыгодно, но останется у ядра Х, и молекулярная орбиталь не образуется.
- АО, образующие МО, должны перекрываться в заметной степени. При этом ядра располагаются так, чтобы перекрывание было максимальным.
- АО, образующие МО, должны обладать одинаковыми свойствами симметрии относительно межъядерной оси образующейся молекулы.
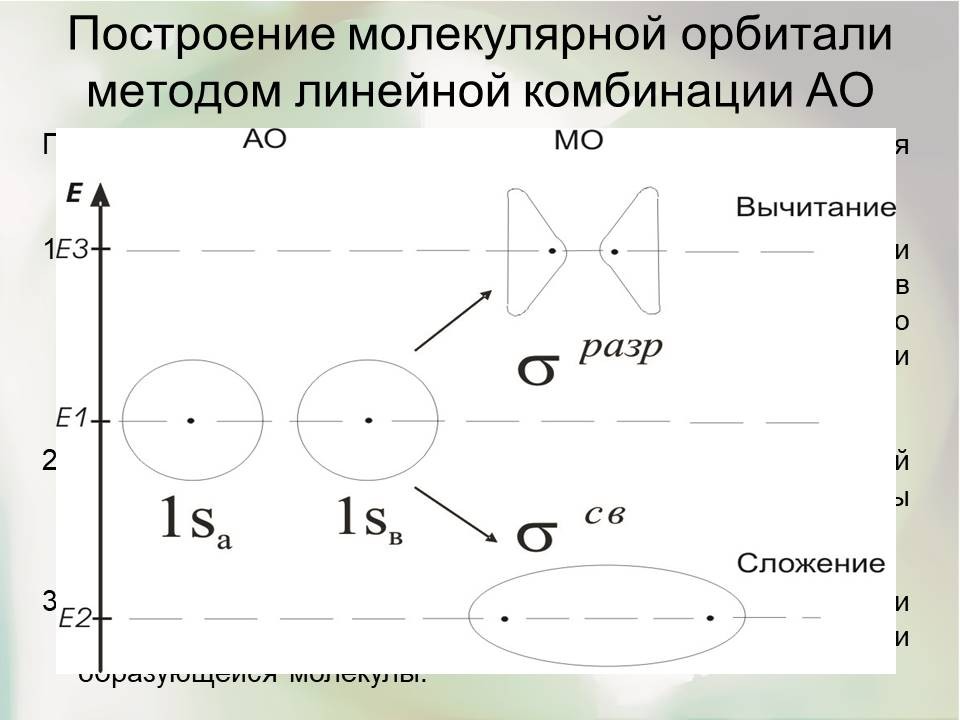
При сложении АО образуется двухцентровая МО, которая характеризуется повышенной электронной плотностью между ядрами. Она имеет более низкую энергию, чем исходные АО. Это связывающая орбиталь (обозначается ![]() ). При вычитании АО образуется двухцентровая МО с пространственным разрывом между ядрами. Электронная плотность сконцентрирована за ядрами, а между ядрами она равна нулю. Подобная МО имеет более высокую энергию, чем исходные АО, и ее называют разрыхляющей (обозначается
). При вычитании АО образуется двухцентровая МО с пространственным разрывом между ядрами. Электронная плотность сконцентрирована за ядрами, а между ядрами она равна нулю. Подобная МО имеет более высокую энергию, чем исходные АО, и ее называют разрыхляющей (обозначается![]() ). Разрыхляющая орбиталь энергетически менее выгодна, чем исходные АО.
). Разрыхляющая орбиталь энергетически менее выгодна, чем исходные АО.
Подразделение МО на связывающие и разрыхляющие основывается на том, какое действие на связь оказывает электрон, поступая на МО. При поступлении электрона на связывающую орбиталь, характеризующуюся более низкой энергией, чем она была в атоме на соответствующей АО, достигается выигрыш энергии; возникает или упрочняется связь между атомами. Энергия связи - разница в энергии АО и связывающей МО. Переход электрона с АО на разрыхляющую МО связан с затратой энергии, в результате чего связь не может возникнуть; либо она дестабилизируется, разрыхляется. Помимо связывающих и разрыхляющих МО в молекулах различают и несвязывающие МО. Энергия электронов на такой МО практически не отличается от энергии на соответствующей АО.
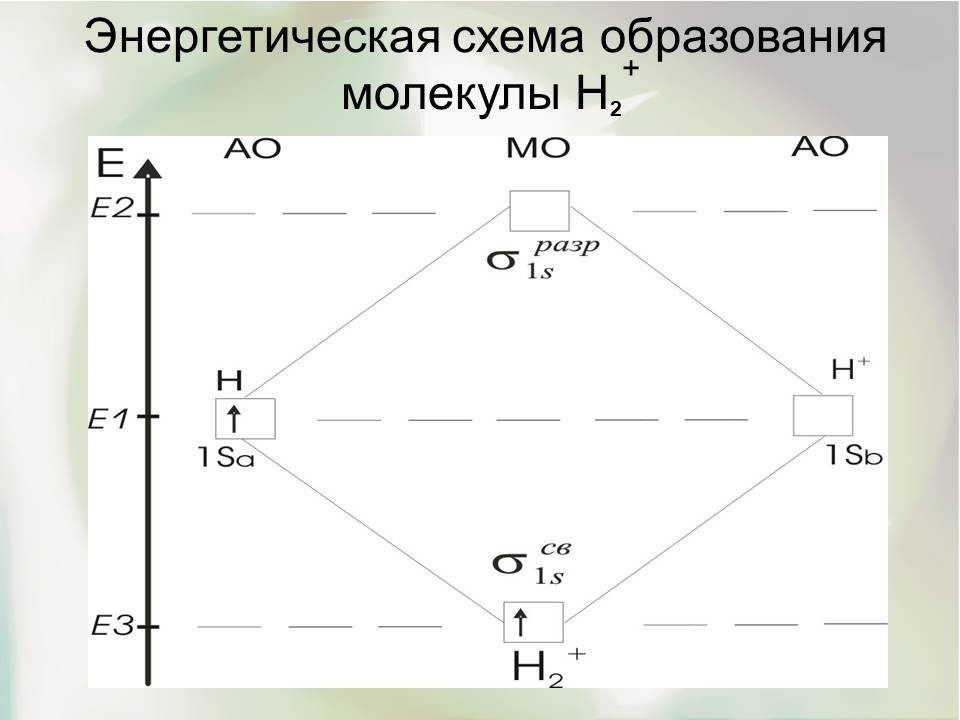
Рассмотрение химических связей в методе МО заключается в распределении электронов в молекуле по ее орбиталям. Пользуясь основными положениями метода МО, объясним образование молекулы H2. Образование МО из атомных орбиталей изображается в виде энергетических схем, на которых по вертикали откладываются значения энергии орбиталей (рис. 2).
Из двух одинаковых 1S орбиталей образуются две молекулярные орбитали: одна из них - результат сложения АО, другая - результат вычитания АО (рис. 2). Энергия первой E2 <E1; энергия второй E3 >E1. Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую МО, возникнет химическая связь, образование которой сопровождается выделением энергии. Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной МО: один из них займет связывающую, а другой разрыхляющую МО. В этом случае химическая связь образоваться не может.
Согласно методу МО образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существование молекулы He2, поскольку в ней два электрона находились бы на связывающей орбитали, а два− на разрыхляющей. Экспериментально подтверждено, что электрон на разрыхляющей орбитали сильнее ослабляет связь, чем её укрепляет электрон на связывающей орбитали. В системе обозначений метода МО реакцию образования молекулы водорода из атомов записывают так:
![]() .
.
В записи используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. Символ каждой МО заключается в круглые скобки и над скобками справа записывается число электронов на этой орбитали. Число валентных связей определяется по формуле:

где
В - число связей.
Nсв - число связывающих электронов в молекуле.
Nразр - число разрыхляющих электронов в молекуле.
В молекуле водорода В=(2-0)/2=1; водород одновалентен. Молекула Н2 диамагнитна, то есть в ней нет неспаренных электронов и она выталкивается из магнитного поля.
Теперь легко объяснить одноэлектронную связь в молекулярном ионе Н2+.
Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь ![]() ∙ 1S.
∙ 1S.
Уравнение процесса:

Процесс является экзотермическим. Число связей в ионе Н2+ равно (1-0)/2=1/2.
Ион Н2+ парамагнитен (имеет неспаренный электрон). Такие частицы втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Метод МО объясняет образование молекулярного дигелий-иона Не2+.Уравнение процесса:

Этот ион обнаружен экспериментально. Число связей в нем (2-1)/2=1/2. Ион парамагнитен (имеет неспаренный электрон). Так как МО соответствует более высокая энергия, чем АО отдельных атомов, то ион Не2+ должен быть менее устойчивым, чем молекула Н2. Этот вывод согласуется с экспериментальными данными: энергия связи Не2+ существенно меньше энергии связи Н2.
Двухатомные молекулы элементов второго периода
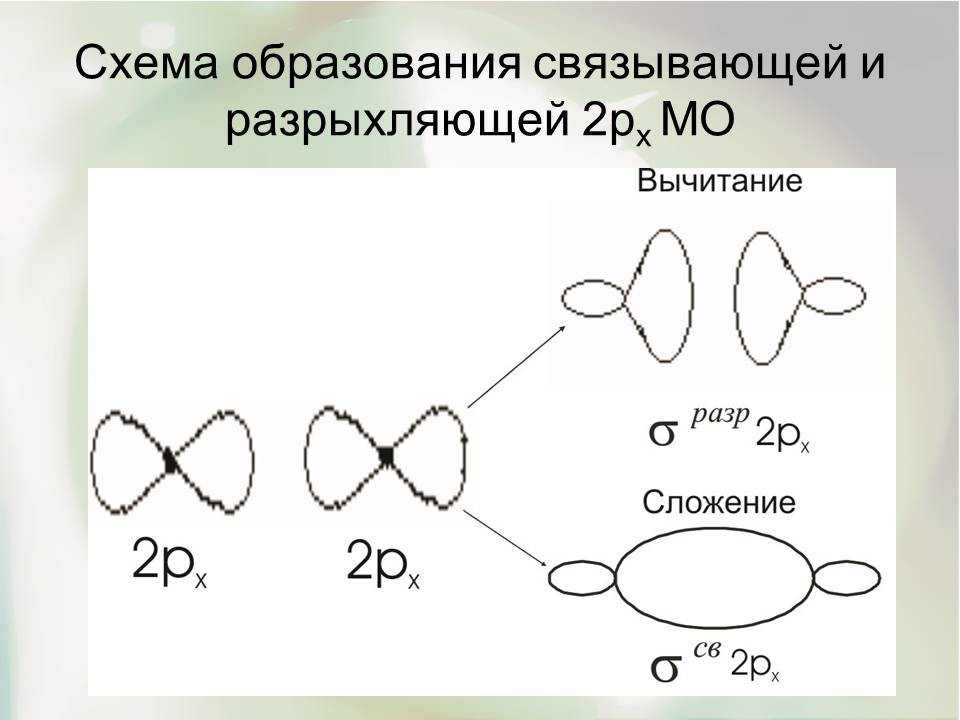
Рассмотренный принцип построения МО из двух АО сохраняется при построении молекул элементов II периода системы Д.И.Менделеева. Они образуются в результате взаимодействия 2S- и 2px-, 2py-, 2pz-орбиталей. Участием внутренних электронов 1S-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2S-орбиталь одного атома взаимодействует с 2S-орбиталью другого атома. При взаимодействии 2p АО возникают МО двух типов: ∙σ2p- и ∙π2р-МО. ∙σ2р-МО образуется при взаимодействии двух 2рx АО, оси симметрии которых совпадают с линией, соединяющей центры атомов.
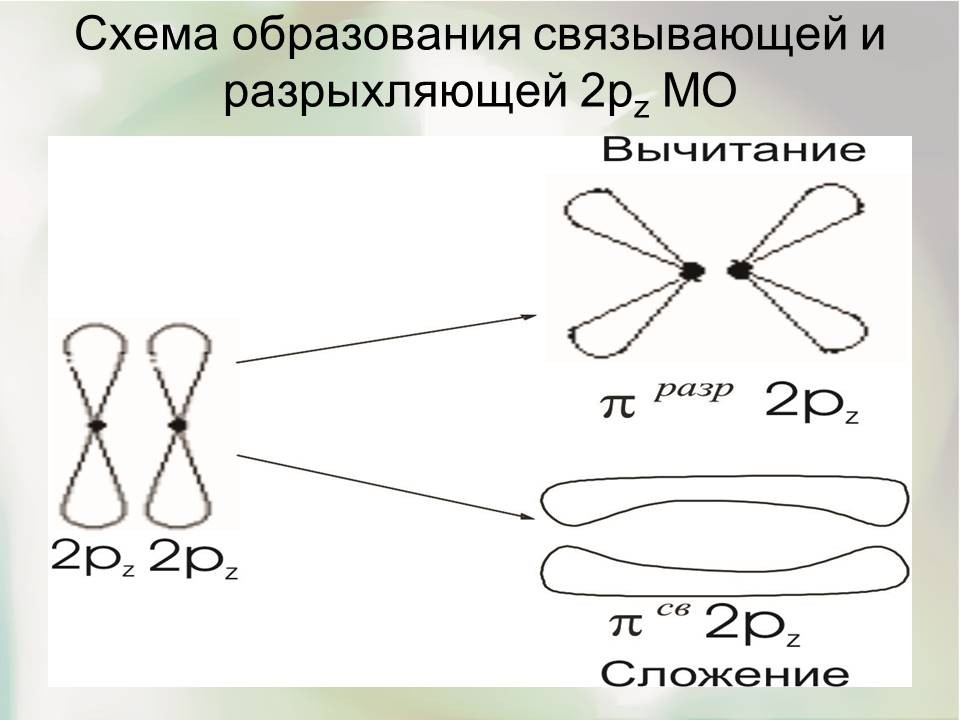
Иное распределение электронной плотности наблюдается для π2р-МО. Они образуются при комбинации двух 2рy- или 2рz- АО, расположенных перпендикулярно оси, соединяющей атомные центры.
Распределение электронной плотности в πсв ∙ 2 рz- МО соответствует двум вытянутым вдоль оси бананообразным областям (эти области составляют единое целое и неотделимы одна от другой). Если вместо 2рz- АО скомбинировать две 2рy- АО, то образуется аналогичная πсв ∙ 2рy- МО, но повернутая на 900 вокруг оси молекулы.
В соответствии со спектроскопическими данными МО двухатомных молекул по уровню энергии располагаются в следующем порядке:

У многоэлектронных атомов энергия 2р-орбиталей выше, чем 2s-орбиталей, и различие это растет по мере роста заряда ядра, т.е. при переходе по периоду от элементов I группы к элементам VIII группы.
При энергетической близости 2s-и 2р- атомных орбиталей электроны на σ 2s- и σ 2рy- молекулярных орбиталях взаимно отталкиваются, поэтому πсв ∙ 2рy- и πсв ∙ 2рz- МО оказываются энергетически более выгодными, чем ![]() ∙ 2рx- орбиталь. После азота различие в энергии s- и р- состояний становятся настолько значительным, что порядок заполнения МО для двухатомных гомоядерных молекул элементов II периода до молекулы азота включительно и для молекул кислорода и фтора оказывается различным: в первом случае орбиталь σ 2рx заполняется после того, как заняты π 2р-орбитали, а во втором (в молекулах O2 и F2) - наоборот.
∙ 2рx- орбиталь. После азота различие в энергии s- и р- состояний становятся настолько значительным, что порядок заполнения МО для двухатомных гомоядерных молекул элементов II периода до молекулы азота включительно и для молекул кислорода и фтора оказывается различным: в первом случае орбиталь σ 2рx заполняется после того, как заняты π 2р-орбитали, а во втором (в молекулах O2 и F2) - наоборот.
Таким образом, порядок заполнения МО для двухатомных гомоядерных молекул, включая молекулу N2, будет соответствовать последовательности:

Рассмотрим некоторые молекулы.
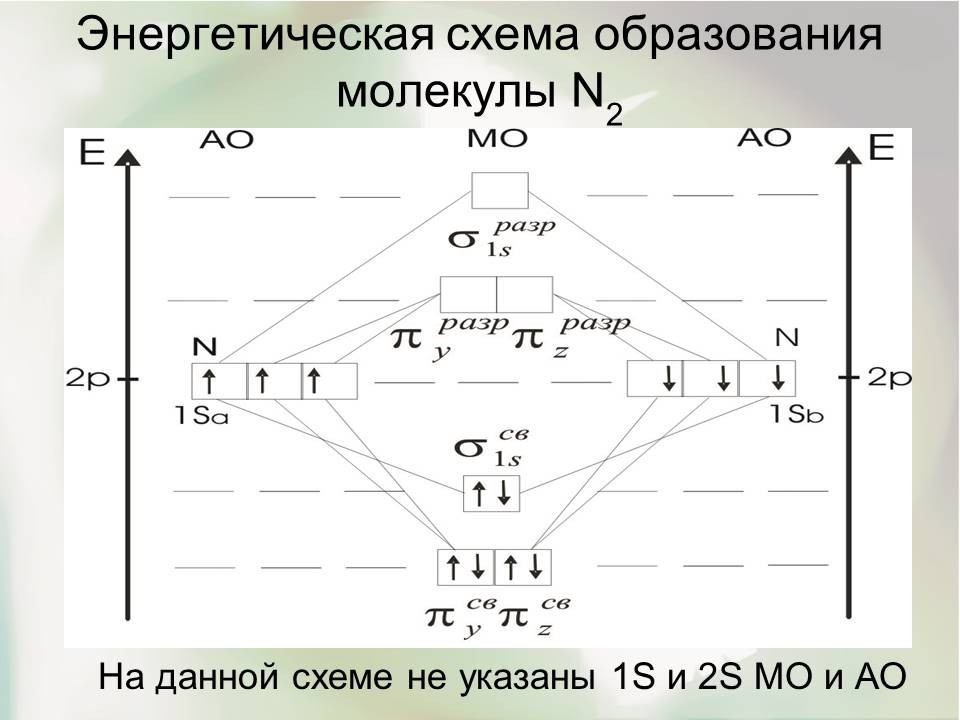
Молекула азота N2
Распределение 14 электронов по МО в молекуле азота записывается:
![]()
Запись можно упростить, обозначив внутренний слой через К:

Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связывающие орбитали, знак минус - разрыхляющие. Число связей в молекуле азота равно трем. Молекула диамагнитна, т.к. неспаренных электронов нет, что подтверждается экспериментом. Избыток в шесть связывающих электронов соответствует представлению о тройной связи. Молекула N2 поэтому наиболее стабильна из всех гомоядерных двухатомных молекул. Тройная связь в N2 образована тремя парами электронов, занимающими МО разной симметрии: σ-типа (1 пара) и π-типа (2 пары). Ее можно рассматривать как наложение неравноценных одной σ- и двух π-связей. Суммарное электронное облако связи имеет цилиндрическую симметрию относительно межъядерной оси. Высокая стабильность молекулы азота обусловлена не только тройной связью, но и тем, что от высшей заполненной до низшей свободной орбитали расстояние велико и возбуждение молекулы, ослабляющее связь, требует затраты довольно большой энергии. Энергия диссоциации молекулы азота D0(N2)=9,759эВ, а межъядерное расстояние rе(N2)=1,0876 ![]() .
.
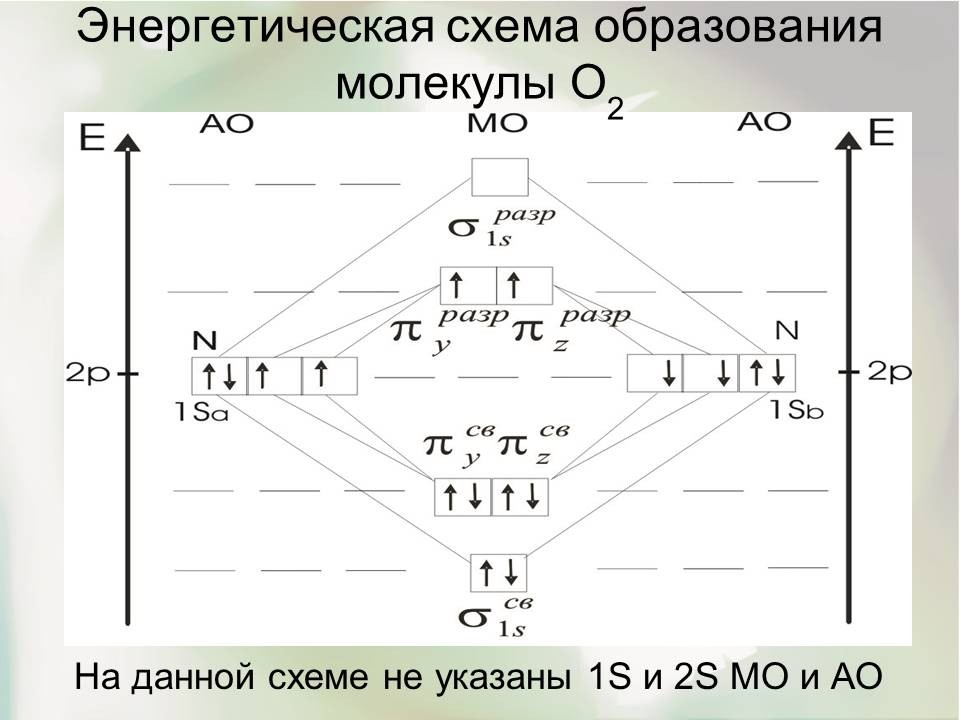
Молекула кислорода О2 - бирадикал
Электроны размещаются по МО в последовательности:

В молекуле две валентные связи. Избыток связывающих электронов составляет две пары. Эту двойную связь можно рассматривать как совокупность σ- и π-связей, отличающихся по симметрии орбиталей и поэтому неравноценных. Двойная связь оказывается менее прочной, чем тройная в молекуле N2, что подтверждается значениями энергии диссоциации молекулы кислорода и межъядерным расстоянием: D0(N2) = 5,116 эВ; rе(О2) = 1,2070![]() .
.
Первое знакомство с двухтомными гомоядерными молекулами элементов II периода приводит к мысли о неподдающейся систематизации их свойств. Так, молекулы элементов начала и конца периода имеют небольшие энергии диссоциации (1,026 и 1,604 эВ для Li2 и F2 соответственно); середины периода - очень высокие (6,240 и 9,759 эВ для С2 и N2), а молекула Ве2 в основном состоянии неустойчива. Все молекулы имеют четное число электронов, но диамагнитны не все: молекулы О2 и В2 парамагнитны.
Теория МО внесла в этот хаос свойств порядок так же, как периодическая система элементов, основанная на электронных конфигурациях атомов, привела в порядок огромное число, казалось бы, противоречивых данных о свойствах химических элементов. Немонотонное изменение прочности связи в ряду двухатомных молекул Li2→F2 не является хаотическим, а закономерно связано с электронной структурой молекул.
В ряду Li2-B2-C2-N2 по мере заполнения связывающих МО уменьшается межъядерное расстояние и увеличивается энергия диссоциации молекул. При переходе от N2 к О2 и далее к F2 по мере заполнения разрыхляющих МО, наоборот, межъядерное расстояние возрастает, а энергия диссоциации молекул уменьшается. Таким образом, энергии диссоциации и межъядерные расстояния изменяются в той же последовательности, что и избыток связывающих электронов в системе.
Молекулы Ве2 и Nе2 нестабильны, т.к. в каждой из них число связывающих электронов равно числу разрыхляющих.
Парамагнетизм молекул В2 и О2 полностью обьясняется теорией МО на основе правила Хунда.
Изменение энергий диссоциации в каждом периоде соответствует наблюдаемому во II периоде. Это следствие того, что набор внешних МО двухатомных молекул в каждой группе аналогичен, так же, как аналогичен набор внешних атомных орбиталей, образующих МО.
В каждой главной подгруппе периодической системы энергии диссоциации молекул монотонно убывают сверху вниз, что связано с участием в образовании МО обладающих все более высокой энергией АО, например 3s- и 3р- в III периоде; 4s- и 4р- в IV периоде и т.д. Единственное нарушение этого порядка наблюдается в последовательности F2→ Cl2.
Двухатомные гетероядерные молекулы элементов II периода
Энергетическая схема образования МО гетероядерных двухатомных молекул, образованных атомами элементов II периода, сходна со схемой образования МО гомоядерных молекул. Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, т.к. различны заряды ядер атомов и число внешних электронов. Чем выше электроотрицательность атома, тем ниже в энергетической схеме будут расположены его атомные орбитали. Так, например, в энергетической схеме образования молекулы NО атомные орбитали кислорода располагаются ниже атомных орбиталей азота. Разница в энергиях исходных АО-полярность связи.
Молекула NO-радикал
На МО молекулы оксида азота(II) должны разместиться 15 электронов: семь из них атома - азота, восемь - атома кислорода. Из этих 15 электронов 11 электронов принадлежат второму энергетическому уровню: пять азота: 2s2 2р3 и шесть кислорода 2s2 2р4.
Электронную конфигурацию молекулы NO можно выразить формулой:

Таким образом, молекула NО имеет 2 ½ валентные связи. Она парамагнитна, т.к. содержит один неспаренный электрон.
Приведенные примеры иллюстрируют возможности метода молекулярных орбиталей в объяснении строения и свойств молекул. В связи с указанными преимуществами метода МО описание электронного строения молекул, а так же изложение проблем химической связи целесообразнее строить на его основе.